例析多池相連電化學(xué)裝置的解題方法
時間:2019年03月13日 分類:教育論文 次數(shù):
【摘要】電化學(xué)模塊是高中化學(xué)基本理論體系中的重要內(nèi)容,是教學(xué)中的重點與難點,文章就多池相連問題中常見題型展開討論,尋找解題方法,幫助學(xué)生建立思維模型,培養(yǎng)學(xué)生邏輯思維能力。
【關(guān)鍵詞】多池相連,電化學(xué),解題方法
1引言
電化學(xué)知識是近幾年全國各省市高考題中的必考考點,它是基于氧化還原反應(yīng)、化學(xué)反應(yīng)中的能量變化等知識的深度學(xué)習(xí),電化學(xué)分為原電池與電解池兩大模塊,但考題中通常不單獨考察,而是多池相連綜合考察,因而要求學(xué)生具有扎實的基礎(chǔ)知識儲備與強大的邏輯思維體系。因此本文舉例分析常見的多池相連問題的題型特點和相應(yīng)的解題方法談?wù)勛约旱囊娊狻?/p>
2無外接電源型
2.1建立認知角度
此類題型關(guān)鍵是確定原電池,判斷方法主要有:找裝置中最活潑金屬,其在裝置為原電池(即能自發(fā)進行氧化還原反應(yīng)的電池),其余為電解池;在電極附近有可燃物通入的裝置是原電池,其余為電解池。
2.2建立角度關(guān)聯(lián)
根據(jù)原電池的形成條件確定其正負極,較活潑金屬或可燃物做負極,另一極為正極。與原電池負極相連的是電解池的陰極,與正極相連的是陽極,串聯(lián)電池中陰陽電極交替出現(xiàn)。
2.3建立思維模型
根據(jù)解題需要建立思維模型,正確書寫電極反應(yīng)方程式,判斷電子轉(zhuǎn)移方向,陰陽離子移動方向等,緊抓相同時間內(nèi)電極通過電子的物質(zhì)的量相等這一橋梁來解答電化學(xué)中的定量計算。例:如圖裝置甲池的總電極反應(yīng)式為2CH。OH+30+4KOH===2K2CO+6}{20。下列敘述正確的是()
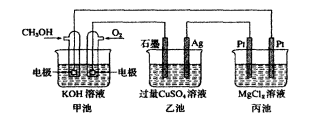
A.甲池是原電池,乙池是化學(xué)能轉(zhuǎn)化為電能的裝置B.乙池中,船電極的電極反應(yīng)式為Ag—e—IAC.反應(yīng)一段時間后,若要使CuS04溶液恢復(fù)到原濃度則向乙池中加入一定量cu(OH),固體D.當(dāng)甲池中消耗標準狀況下28OraL0,,理論上丙池中最多產(chǎn)生固體1.45g解析:甲池中有CH。OH通入做原電池,乙池和丙池為電解池,能量是電能轉(zhuǎn)化為化學(xué)能,A錯。
甲池中負極為通入cH。0H的一極,正極為通入O的一極,乙池中Ag作陰極,電極反應(yīng)為cu+2e一===Cu,B錯。恢復(fù)原溶液的原則是電解了什么則加入什么,乙池中;2CuSOd+2H20墨2Cu+2H2so4+02f,應(yīng)加入CuO或CuCO3,C錯。丙池中:MgC12+2H20Mg(0H)2l+cl2f+H2f,當(dāng)消耗標況下280mL02,0.0125mol時,轉(zhuǎn)移e-O.05mol,生成Mg(OH),0.025mol,質(zhì)量為1.45g。
3有外接電源型
(1)建立認知角度:針對有電源的此類題型,全部為電解池、電鍍池或精煉池等。
(2)建立角度關(guān)聯(lián):若已知電源的正負極,則與電源負極相連的是電解池的陰極,與正極相連的是陽極,根據(jù)串聯(lián)電池中電極交替出現(xiàn)原則順推其他電極;若未知電源的正負極,則需要根據(jù)某極發(fā)生的現(xiàn)象逆推電極(隱含著電子流向、陰陽離子移動方向等解題依據(jù))。
(3)建立思維模型:與無外接電源型類似例:如圖裝置
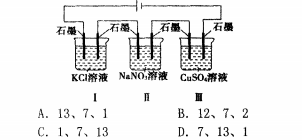
電解一一段時間,當(dāng)某極析出0.32gCu時,I、II、III中溶液pH分別為(溶液足量,體積均為100mL且電解前后溶液體積變化忽略不計)()解析:I、II、III均為電解池,I中石墨(左)與電源正極相連為陽極,石墨(右)為陰極,II、III中依次交替。n(Cu)=0.O05mo1,由IⅡ中陰極的電極反應(yīng)為Cu2++2e:==cu可知轉(zhuǎn)移eO.Olmo1,I、II、III中電解方程式分別為2KC1+2H2()2KOI-{+H2f+c1zf、2H20竺2H,f+02f、2CUSO4+2HeO~=2Cu+Ozf+2sQ。當(dāng)轉(zhuǎn)移eO.Olmol時,則I中生成Of0.01mol,c(0K)=0.1mol/L,州=13;II電解水,溶液仍然呈中性,溶液的pH=7;III中生成0.Olmolf,c(}r)=0.1rnol/L,pH=l,故選A。
4雙控型
此類題型是前面兩類的綜合運用,通過電建的斷開與閉合,從而改變認知角度。例:有關(guān)下列裝置的敘述中正確的是()
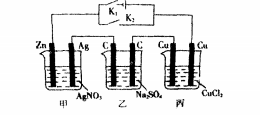
A.斷開K,閉合K2后,甲、乙池能將化學(xué)能轉(zhuǎn)化為電能B.斷開K,閉合K,后,丙池中C(c1)減小C.斷開,閉合K.后,乙池右邊c電極上的電極反應(yīng)式為401-{4e一:==2H2O+02fD.斷開K。.閉合K后,一段時間后甲、乙、丙三池中的陽極均被腐蝕了解柝斷開K,閉合K2后,整個裝置中為無外接電源型,由于鋅銀銅中鋅為最活潑金屬,故甲池是原電池,則乙、丙兩池為電解池,乙池是將電能轉(zhuǎn)化為化學(xué)能,A錯。
甲池中Zn做負極,丙池中與zn相連的Cu(右)電極為陰極,Cu(左)電極為陽極,cu一2e一=Cu,金屬電極做陽極,參與電極反應(yīng),cl一不放電,B錯。斷開K。,閉合K后,三個池子均變成電解池,甲池中Zn與電源負極相連做陰極,則乙池中C(右)電極為陽極,40H-4e一:2H20+0,f,c正確;石墨是惰性電極,本身不參與電極反應(yīng),D錯。
解答電化學(xué)的相關(guān)題型,氧化還原反應(yīng)是基礎(chǔ),原電池與電解池的工作原理是關(guān)鍵,經(jīng)分析發(fā)現(xiàn),無論電化學(xué)以哪種題型出現(xiàn),基礎(chǔ)知識都是考察的重點和核心,這就要求學(xué)生在強化基礎(chǔ)知識的同時,不斷減少迷思概念,形成一定的邏輯思維體系,構(gòu)建解題模型,當(dāng)遇到綜合性較強的題型時就能迎刃而解了。
【參考文獻】
[1]李輝,徐丈華.電化學(xué)電極反應(yīng)式書寫“三步曲”[J].高中數(shù)理化.2015(5):56—58.
化學(xué)教學(xué)論文范文:高中化學(xué)實驗中問題解決方式
學(xué)好數(shù)理化,走遍全天下,由此可見這三門課程的重要性,這也是高中理科中的主要學(xué)科,尤其是高中化學(xué)的學(xué)習(xí),在高中化學(xué)學(xué)習(xí)中有一些實用性強與生活密切相關(guān)的知識點,這些知識點可以通過化學(xué)實驗課程內(nèi)容體現(xiàn)出來,實驗來源于生活,也引領(lǐng)著生活,根據(jù)生活講述其中的重要原理,從原理提升生活的實踐質(zhì)量。下面文章就總結(jié)高中化學(xué)學(xué)習(xí)中的實驗內(nèi)容,并提出自己的看法,希望可以對化學(xué)知識的學(xué)習(xí)有重要的幫助。
SCI期刊目錄
熱門核心期刊目錄
SCI論文
- 2024-07-11sci論文接收后多久下doi號
- 2024-06-19COMPUTER GRAPHICS FORUM期刊簡
- 2024-01-03今日話題:sci審稿狀態(tài)“reject
SSCI論文
- 2024-01-11發(fā)表ssci論文可以破格晉升嗎
- 2024-10-12ssci論文申請撤稿什么時候能轉(zhuǎn)投
- 2023-03-06新聞與傳播學(xué)SSCI期刊
EI論文
- 2024-02-21計算機視覺方向論文怎么發(fā)EI快
- 2023-02-07ei會議提前多久開始征文
- 2023-02-01國際性ei會議都是英文嗎?
SCOPUS
- 2023-09-12如何發(fā)表Scopus論文技巧分享
- 2023-03-24scopus收錄論文速度怎么樣
- 2023-04-12scopus數(shù)據(jù)庫收錄哪些門類的文獻
翻譯潤色
- 2022-03-31英文期刊編輯回復(fù)論文表達不行怎
- 2023-05-09鍛造相關(guān)中文文章怎么翻譯為英文
- 2024-08-16國際中文期刊發(fā)表論文應(yīng)該用什么
期刊知識
- 2017-05-11機械工程方面論文要加急發(fā)表去哪
- 2024-09-29中文核心期刊投稿要推薦審稿人嗎
- 2018-03-15學(xué)報上發(fā)表論文最早多久見刊
發(fā)表指導(dǎo)
- 2018-09-29不銹鋼熱處理論文適合投的期刊
- 2015-07-10如何向核心期刊投
- 2024-08-16工程監(jiān)理人員怎么選刊并投稿