硅酸鈣納米線復合電紡絲支架的制備及離子釋放研究
時間:2021年04月21日 分類:推薦論文 次數:
摘要:電紡絲支架已被廣泛用于組織工程領域,其中硅酸鈣等生物活性陶瓷復合的電紡絲支架,在應用中展現出了優異的生物活性。硅酸鈣復合電紡絲支架中硅酸鈣降解釋放的硅酸根離子(SiO32-)已被證實具有促進成血管性能,但其有效活性離子濃度范圍比較窄,僅在0.79~1.8μg/mL之間。因此精確控制組織工程材料的離子釋放濃度,使材料釋放的離子能較長時間保持在有效活性濃度范圍,對于組織工程應用具有重要意義。本研究通過調節電紡絲孔徑大小及硅酸鈣納米線的不同復合方式,制備了多種硅酸鈣復合電紡絲纖維支架,并比較了其在體外環境下的離子釋放模式及對人臍靜脈內皮細胞的增殖促進作用。實驗結果表明,混紡及同時電噴-電紡復合方式的小孔徑硅酸鈣復合電紡支架由于高分子的疏水作用和小孔徑結構對離子擴散的阻礙,可以實現離子緩釋。通過體外細胞實驗發現,具有離子緩釋效果的支架可以更好地促進人臍靜脈內皮細胞的增殖,說明通過調控支架離子緩釋,可以有效調控其生物活性,獲得最佳組織工程應用效果。
關鍵詞:硅酸鈣;靜電紡絲;可控釋放;降解;靜電噴霧
靜電紡絲支架因具有類細胞外基質的三維結構、大比表面積、高孔隙率[1-3],被廣泛應用于血管[4-5]、心肌[6-7]、神經[8-9]等組織工程創傷修復[10]領域。電紡絲支架經過多年的研究發展,通過在其中引入活性藥物[11]和活性陶瓷等[12]賦予了電紡絲支架粘附、增殖、遷移、分化等生物活性。硅酸鈣等生物活性陶瓷分解釋放的SiO32-,不僅被證實具有促進骨[13]、牙齒[14]等硬組織再生的作用。
近年來陸續發現SiO32-還具有促進血管[15]、脂肪[16]、皮膚創面[17]、毛囊[18]、心肌[19]等多種軟組織修復的生物活性。前期研究中,硅酸鈣等生物活性陶瓷通過混紡[19]或者噴涂[20]的方式與電紡絲進行復合,促進了組織的修復。但是,不同的組織修復所需的活性SiO32-濃度范圍各有差異[21],以促進成血管性能為例,據Li等[22]報道,SiO32-有效促進成血管的濃度范圍為0.79~1.8μg/mL,有效濃度范圍較窄,這對于材料中SiO32-的釋放行為提出了要求。
雖然前述工作報道的硅酸鈣等生物活性陶瓷復合電紡絲支架中釋放的SiO32-具有促進軟組織修復的作用,但并未關注材料中SiO32-的釋放行為對于軟組織修復效果的影響。因此,精確控制組織工程材料中硅酸鹽陶瓷降解產生的SiO32-的釋放行為具有重要意義。 前期的研究[23-25]表明,孔徑的大小對材料內部的藥物釋放有重要影響,因此本研究提出的第一個假設是,通過調節電紡絲的孔徑結構可以有效調控生物活性離子的釋放行為。
此外,醫用電紡絲支架常用的高分子主要有聚己內酯(PCL)、聚乳酸(PLA)等疏水性高分子,有文獻[26]報道這些疏水性高分子的疏水作用將阻礙內部藥物釋放,因此本研究提出第二個假設是,硅酸鈣在復合材料體系內的分布位置不同,如纖維絲內部、纖維表面均勻分布、集中分布于支架外表面、“三明治”夾心層等,將會導致復合材料中硅酸鈣受到的高分子疏水作用有所不同,從而影響SiO32-的釋放行為。基于以上假設,本研究考慮可以通過調控硅酸鈣/高分子復合組織工程材料的孔徑及硅酸鈣顆粒在復合材料中的位置來調控SiO32-釋放。
因此,本研究制備了不同孔徑復合電紡絲支架,并結合靜電噴霧技術,構建了多種硅酸鈣復合形式的電紡絲支架,探討了孔徑及復合形式對于材料親疏水性及離子釋放的影響,并在此基礎上考察了復合支架的不同離子釋放行為對于血管內皮細胞的影響。
1實驗方法
1.1實驗試劑
本研究采用的藥品四水合硝酸鈣(Ca(NO3)2·4H2O)、九水合硅酸鈉(Na2SiO3·9H2O)、明膠購于中國醫藥集團上海化學試劑有限公司;聚乳酸(PLA,分子量6萬)購于濟南岱罡生物工程有限公司,聚己內酯(PCL,分子量8萬);六氟異丙醇(HFIP)購于Sigma-Aldrich公司。
1.2硅酸鈣納米線的制備與表征
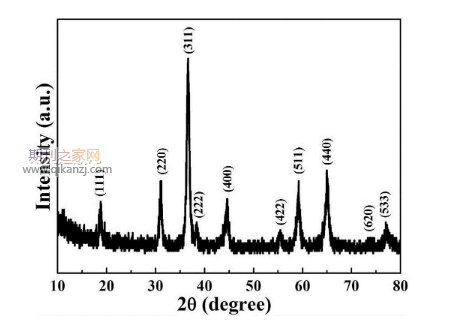
根據文獻[27]報道,采用水熱法合成硅酸鈣納米線(Ca6(Si6O17)(OH)2,CSH)。即,將9.446g的Ca(NO3)2·4H2O和11.368g的Na2SiO3·9H2O分別溶解于100mL的去離子水中,磁力攪拌1h后,將混勻的溶液轉移至水熱釜中200℃反應24h。待水熱釜自然冷卻后,將制得的CSH用去離子水和乙醇分別沖洗三次,于60℃烘箱中烘干24h備用。采用18kW轉靶X射線衍射儀分析CSH的物相組成;使用場發射透射電子顯微鏡(JEM-2100F)觀察納米線的結構。
1.3不同孔徑電紡絲的制備
本研究通過調節高分子電紡絲(Electrospun,ES)溶液的濃度調節電紡絲孔徑的變化。即,配方將不同質量的PLA、PCL、明膠以35/35/30(w/w/w)的比例溶解于HFIP中,將電紡絲溶液置于磁力攪拌器上以120r/min的速度攪拌48h直至澄清,分別得到濃度(w/v)為5%、10%、18%、22%的電紡絲溶液,分別命名為5ES、10ES、18ES、22ES。隨后各溶液分別轉移到20mL注射器中進行靜電紡絲。
由于不同濃度的電紡絲溶液的紡絲液性質不同,為能制備到形態良好的電紡絲纖維,本研究對電紡絲的電壓、流速、針頭與基板的間距均進行了相應的調節,其中各組溶液的電壓、流速、針基板間距等紡絲參數進行設置:對各組電紡絲SEM照片采用ImageJ軟件測量50根以上的纖維,并統計分析得到其直徑和孔徑[28],通過測量50個以上由纖維圍成的孔的尺寸,并統計分析得到其孔徑。
1.4硅酸鈣復合電紡絲支架的制備與表征
本研究通過四種不同方式制備硅酸鈣復合電紡絲支架:(a)混紡CSH;(b)電紡絲的同時電噴CSH;(c)在電紡膜表面電噴CSH;(d)表面噴有CSH的電紡膜再進行電紡絲。四種方法制備的電紡絲支架,分別命名為CSH@ES、CSH&ES、CSH//ES、ES/CSH/ES。具體制備方法如下。(a)CSH@ES:將0.05gCSH加入到10mL5ES或22ES電紡絲溶液中,分別以5ES或22ES的電紡絲參數進行混紡而制得;(b)CSH&ES:在制作10mL5ES或22ES電紡絲的同時靜電噴霧10mL含0.05g的CSH乙醇溶液而制得,其中電噴參數設定為電壓18kV及針基板間距15cm。
(c)CSH//ES:在制作10mL5ES或22ES電紡絲后,于纖維膜表面采用前述靜電噴霧條件電噴10mL含0.05g的CSH乙醇溶液而制得;(d)ES/CSH/ES:在制作5mL5ES或22ES溶液電紡絲后,在纖維膜上電噴10mL含0.05g的CSH乙醇溶液,之后再作5mL5ES或22ES溶液電紡絲,形成以CSH為夾心層的“三明治”纖維膜結構。上述制備過程中,通過控制摻入或電噴相同含量的CSH以保證各組的CSH含量一致。硅酸鈣復合支架的接觸角表征通過水接觸角分析儀(FM40Mk2Easydrop)進行測試;利用電感耦合等離子體發射光譜儀(ICP-OES)檢測支架在細胞培養液中浸泡1、3、5、7d的SiO32-釋放行為。
1.5細胞實驗
本研究中采用人臍靜脈內皮細胞(HUVEC,購自中科院細胞庫)研究硅酸鈣復合電紡絲支架對細胞的增殖影響。將HUVEC種于纖維支架表面,并培養于37℃、含5%二氧化碳空氣的細胞培養箱中,隔天更換細胞培養液。在預設時間點1、3、7d時采用CellCountingKit-8(CCK8,Japan)試劑盒對細胞活性進行檢測。為了觀察HUVEC在材料上的粘附效果,將培養1、3d后的細胞樣品培養液吸出,并用4%多聚甲醛固定30min后,采用熒光素異硫氰酸酯(FITC)-鬼筆環肽浸泡材料上的細胞30min以染色細胞骨架,用DAPI浸泡10min以染色細胞核,之后在激光共聚焦顯微鏡下觀察細胞形態。
2結果與討論
2.1CSH的組成與形貌
本研究通過水熱法成功制備了硅酸鈣納米線。通過XRD對CSH的物相進行了表征并與標準卡片PDF#23-0125(Ca6Si6O17(OH)2)比較,結果顯示CSH的主要峰位均與Ca6Si6O17(OH)2保持一致。水熱法制備的CSH納米線具有一維結構,平均直徑約20nm,長度3~7μm。
2.2不同孔徑的電紡絲形貌
在未復合硅酸鈣納米線的情況下,通過調節電紡絲溶液濃度與電紡絲參數,分別制備了不同結構的電紡絲纖維。隨著電紡絲溶液濃度的增大并相應調節電壓、流速、針頭與基板等電紡絲參數后,可看出所制得的纖維直徑和相應的孔徑都逐漸增大。 進一步對電紡絲作纖維直徑與孔徑的測定和統計分析表明,纖維直徑與孔徑最小的5ES組,其纖維直徑和孔徑分別為0.24和0.68μm;纖維直徑與孔徑最大的22ES組,其纖維直徑和孔徑分別為10.27和50.46μm。后續實驗將采用孔徑最小的5ES和孔徑最大的22ES(分別命名為小孔徑組和大孔徑組)探索孔徑對離子釋放的影響。
2.3硅酸鈣復合電紡絲支架的形貌特征及潤濕性能
本研究通過將電紡絲溶液與CSH進行混紡制備了CSH@ES,在電紡絲纖維的同時電噴CSH顆粒,制備得到了CSH&ES,在已紡纖維表面電噴CSH顆粒制備了CSH//ES,在表面電噴了CSH的電紡絲表面再紡絲一層構建CSH的夾心“三明治”結構得到ES/CSH/ES。混紡的CSH@ES的電紡絲纖維表面光滑,無肉眼可見的CSH納米線分布于纖維表面,但通過TEM觀察可知,CSH均勻分散于纖維絲內部。
由于電噴過程中,噴出的液滴中乙醇溶劑不斷揮發,CSH納米線發生團聚,最終在基底上形成CSH團聚體顆粒。同時電噴-電紡的CSH&ES,顆粒均勻分布于整個電紡絲支架體系內,CSH團聚體顆粒不僅分布于支架表面,還大量被電紡纖維纏繞鑲嵌于纖維支架中。而CSH//ES中,大量CSH團聚體顆粒因靜電作用均勻吸附于電紡絲纖維表面,展示了CSH//ES支架表面的CSH團聚體顆粒的放大照片,可以看到顆粒由大量細小的納米線團聚而成,其直徑在1~2μm。而“三明治”結構的ES/CSH/ES,因CSH位于夾心層位置,表面僅可觀察到光滑的電紡絲,無明顯的CSH暴露。
納米材料評職知識:納米化學論文參考文獻
3結論
本研究采用硅酸鈣高分子復合電紡絲膜材料研究了復合材料釋放SiO32-規律及其細胞生物學效應,可以得出如下結論:1)通過調節電紡絲溶液濃度獲得了不同孔徑大小的電紡絲支架;通過靜電紡絲與靜電噴霧技術的不同組合方式,制備得到了具有不同分布特點的硅酸鈣納米顆粒/高分子復合電紡絲材料;2)在相同陶瓷顆粒分布的情況下,電紡絲支架孔徑越小,離子釋放越緩慢;3)電紡絲支架在具有相同孔徑的情況下,硅酸鈣納米線分布于纖維絲內部或被纖維絲緊密纏繞在支架內部的復合電紡絲材料,由于疏水高分子包裹效應導致離子釋放緩慢,具有緩釋特性;4)具有離子緩釋作用的小孔徑混紡及同時電紡-電噴陶瓷/高分子復合電紡絲材料可有效促進內皮細胞的增殖。
5)本研究通過調節孔徑和CSH的復合方式,發現小孔徑及混紡或同時電噴-電紡的復合形式對于離子緩釋效果最佳,驗證了其在促進細胞增殖方面的優勢,有望為新型創傷敷料的開發提供參考。但是,體內的液體動態流動環境與體外模擬的液體環境存在較大差別,復合支架在體內的最佳促修復離子釋放濃度也與體外存在一定差異,本研究得出的上述組織工程復合支架材料的規律還有待動物實驗的驗證。
參考文獻
[1]XIEX,CHENY,WANGX,etal.Electrospinningnanofiberscaffoldsforsoftandhardtissueregeneration.JournalofMaterialsScience&Technology,2020,59:243-261.
[2]ZHANGY,DOUL,MAN,etal.Biomedicalapplicationsofelectrospunnanofibers.SurfaceReviewandLetters,2020,27(11):1-26.
[3]NIEMCZYK-SOCZYNSKAB,GRADYSA,SAJKIEWICZP.Hydrophilicsurfacefunctionalizationofelectrospunnanofibrousscaffoldsintissueengineering.Polymers,2020,12(11):2636.
[4]XUF,FANY.Electrostaticself-assemblemodifiedelectrospunpoly-L-lacticacid/poly-vinylpyrrolidonecompositepolymeranditspotentialapplicationsinsmall-diameterartificialbloodvessels.JournalofBiomedicalNanotechnology,2020,16(1):101-110.
[5]AWADNK,NIUH,ALIU,etal.Electrospunfibrousscaffoldsforsmall-diameterbloodvessels:areview.Membranes,2018,8(1):15.
作者:包峰1,2,常江1,2
SCI論文
- 2022-11-10ssci從投稿到發表要多久?
- 2024-04-01ANNALS OF PHYSIC最新分區是幾區
- 2023-07-06博士有SSCI期刊發表論文經歷重要
SSCI論文
- 2023-12-25AHCI發表論文算學術成果嗎
- 2023-08-24論文發表多久可以被ssci收錄
- 2023-06-14發ssci論文能查到嗎查詢流程
EI論文
- 2022-12-07ei期刊論文發表有難度嗎
- 2023-06-28ieee xplore 是ei檢索嗎
- 2023-02-07ei會議提前多久開始征文
SCOPUS
- 2023-04-12scopus數據庫收錄哪些門類的文獻
- 2023-03-28scopus收錄哪些學科的期刊
- 2023-03-20scopus高級檢索功能怎么用?
翻譯潤色
- 2023-05-09鍛造相關中文文章怎么翻譯為英文
- 2023-05-11生物醫學sci論文潤色有用嗎
- 2023-05-06基因測序文章怎么翻譯潤色
期刊知識
- 2022-04-02論文三版起發需要寫多少字
- 2015-06-05發表宗教類文章的核心期刊
- 2020-08-05sci論文怎么修改
發表指導
- 2022-03-15留守兒童教育已發表過的論文
- 2020-07-28臨床麻醉論文發表選刊方法
- 2018-03-17審稿快的生物類核心期刊多久可以